| title | subtitle | author | job | framework | highlighter | hitheme | widgets | mode | knit | |
|---|---|---|---|---|---|---|---|---|---|---|
Vähi immuunsus ja vähiravimid |
Onkobioloogia |
Taavi Päll |
lektor, Tallinna Tehnikaülikool |
io2012 |
highlight.js |
tomorrow |
|
selfcontained |
slidify::knit2slides |
--- .segue .dark .nobackground
- Helper T rakud (Th) on CD4+ ja vahendavad Tc ja B rakkude aktivatsiooni.
- Tsütotoksilised T rakud (Tc) on CD8+ ja vahendavad patogeenide ja nakatunud rakkude eemaldamist.
- Regulatoorsed T rakud (CD4+CD25+) supresseerivad Th ja Tc rakke, kontrollivad autoimmuunsust.
---&twocol
***=left
a) MHC klass I molekulid presenteerivad enda antigeene.
b) Rakud millel MHC I puudub või
c) rakud mis ei presenteeri enda antigeeni lüüsitakse tsütotoksiliste rakkude poolt.
Vasakul, MHC I; paremal, MHC II. Joonis: PDB101.
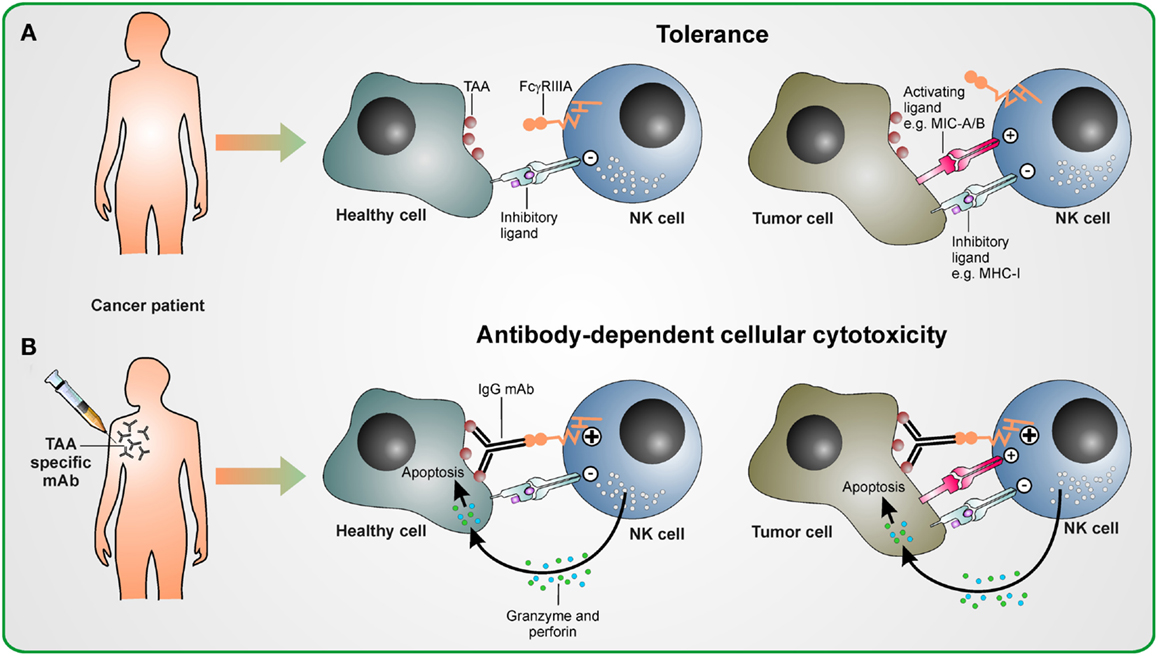
- Fc retseptoreid ekspresseerivad rakud - NK rakud ja makrofaagid seovad antikehadega kaetud raku ja tapavad selle
- komplement seostub rakule seostunud antikehadele ja tapab raku muutes selle membraani poorseks
--- .segue .dark .nobackground
---&twocol
-
- aastal oletas saksa-juudi päritolu arst Paul Ehrlich (1854-1915) et immuunsüsteem hoiab ära kartsinoomide tekke, mis vastasel juhul oleksid palju sagedasemad.
- Vähi immuunoseire hüpotees oletas, et tüümusest pärit rakud monitoorivad keha kudedes ka uusi transformeerunud rakke Frank Macfarlane Burnet, 1970.
***=right
***=left
Pilt: wikipedia.Vähirakud saavad moodustada uue vähi ainult geneetiliselt identses backgroundis, vastasel juhul nad hävitatakse immuunsüsteemi poolt
Pilt:["Allogeneic IgG combined with dendritic cell stimuli induce antitumour T-cell immunity"](http://www.nature.com/nature/journal/v521/n7550/full/nature14424.html)- Alternatiivseks hüpoteesiks vähirakkude ja immuunsüsteemi interaktsioonide kirjeldamiseks on vähi immuunokujundamise.
- Vähi täielik elimineerimine immuunsüsteemi poolt on immuunokujundamise üks stsenaarium.
- Teine stsenaarium on immuunsüsteemi poolt kujundatud vähirakkude repertuaari esiletõus.
- Immuunsüsteemiga kohandunud vähirakud on kas
- vähem immuunogeneesed,
- suurenenud võimega inhibeerida vähivastast immuunvastust.
- Kõrgem vähi intsidents immuunosupressiivset ravi saavatel organi transplantatsiooni läbinud patsientidel.
- Vähipatsientidel tekib oma vähi vastu immuunvastus.
- Vähisiseste tsütotoksiliste (CD8+) ja immuun-protektiivsete regulatoorsete (CD25+Foxp3+) T rakkude lokalisatsioon.
---&twocol
- Organi transplantatsiooni läbinud patsiendid saavad tugevat immuunosupressiivset ravi.
***=left
Nahavähi populatsioon-standardiseeritud intsidents organi transplantatsiooni patsientidel (Norra ja Holland).
| Nahavähk | intsidentsi kasv |
|---|---|
| SCC | 65-korda |
| huule SCC | 20-korda |
| BCC | 10-korda |
| melanoom | 3.4-korda |
| Kapoosi sarkoom | 84-korda |
| Site of cancer | No. cases observed | No. cases expected | Ratio obs/exp (adj) |
|---|---|---|---|
| non melanoma skin | 127 | 5.1 | 21.7 |
| thyroid other endocrine | 30 | 2.1 | 11.0 |
| mouth tongue lip | 22 | 1.6 | 10.0 |
| cervix vulva vagina | 39 | 3.6 | 9.4 |
| non-Hodgkins lymphoma | 25 | 2.4 | 8.5 |
| kidney ureter | 32 | 3.5 | 8.0 |
| bladder | 26 | 4.7 | 5.2 |
| colorectal | 38 | 10.5 | 3.6 |
| lung | 30 | 12.5 | 2.5 |
| brain | 10 | 4.1 | 2.6 |
| prostate | 11 | 5.2 | 2.3 |
| melanoma | 7 | 4.1 | 2.0 |
| breast | 15 | 13.6 | 1.2 |
---&twocol
***=right
***=left
- Metsik tüüpi või RAG2 -/- hiirtele süstiti naha alla 100 $\mu$g kartsinogeenset 3-metüülkolantreeni (methylcholanthrene, MCA) ja jälgiti vähiteket.
- 160 päeva pärast oli 9/15 RAG2-/- hiirel moodustunud MCA-indutseeritud vähid, samas oli sama moodi indutseeritud vähk tekkinud ainult 2/15 wild-type hiirel.
- RAG2-/- hiirtel puuduvad T-, B- ja NK-T rakud.
---&twocol
***=right
***=left
- Immuunopuudulikele RAG2-/- hiirtele või metsik tüüpi hiirtele transplanteeriti naha alla 100'000 vähirakku, mis pärinesid RAG2-/- või wt hiirtest eraldatud MCA-indutseeritud tuumoritest.
- Süngeensetest wt hiirtest pärit 17 erineva vähi rakud moodustasid tuumoreid 100% (17/17) wt hiirtes.
- RAG2-/- hiirtest pärit vähirakud (20 erinevast tuumorist) moodustasid tuumoreid ainult 40% juhtudest (8/20) kui neid transplanteeriti sama geneetilise tagapõhjaga imuunkompetentsetele hiirtele.
- Mutantsete vähi ja normaalsete valkude erinevused on väikesed: RAS, TP53, BCR-ABL.
- Trioosfosfaat isomeraas (glükolüüsi rada) on mitmetes vähkides immunogeenne.
- Mutantse RAS valgu struktuur ei ole muutunud (nt. KRASG12V vs. wt KRAS), madal immunogeensus ja lisaks on onkogeensed RAS valgud madalalt ekspresseeritud.
- hTERT on üleekspresseeritud 70-80% vähkides. Maksakartsinoomi patsientidel hTERT-vastased antikehad veres. Nende antikehade roll progressioonis ebaselge.
- HER2/neu positiivsed rinnakartsinoomid, seal 10-20x üleekspressioon (trastuzumab).
- GD3 gangliosiid (siaalhapet sisaldav glükosfingolipiid) on mitmetes vähkides (melanoon sh.) üle ekspresseeritud.
- TSTA - tumor specific transplantation antigens (TA) strukturaalselt uudsed, kindla vähi või vähitüübiga seotud antigeenid mida ei esine normaalsetes kudedes.
- TATA/TAA - tumor associated TA -- vähis ekspresseeritud normaalsed valgud mille suhtes pole mingil põhjusel täielikku tolerantsust tekkinud.
| Vähitüüp | Valk | Antigenne peptiid |
|---|---|---|
| melanoom, suuõõne kartsinoom, maksa kartsinoom, mitte-väikserakuline kopsuvähk | MAGE | EADPTGHSY, SAYGEPRKL |
| melanoom | türosinaas | MLLAVLYCL, YMNGTMSQV |
| käärsoole kartsinoom | kartsino-embrüonaalne antigeen (CEA) | YLSGANLNL |
| rinna- ja munasarja kartsinoomid | HER2/neu | KIFGSLAFL |
| pea-kaela kartsinoom | kaspaas 8 | FPSDWCYF |
| krooniline müelogeenne leukeemia (CML) | BCR-ABL | ATGFKQSSKALQRPVAS |
| eesnäärme kartsinoom | eesnäärme spetsiifiline antigeen (PSA) | FLTPKKKLQCV, VISNDVCAQV |
- BALB/c hiiri immuniseeriti 3-MC-indutseeritud Meth A fibrosarkoomi lüsaadiga
- Immuniseeritud hiirtest eraldati antigeeni presenteerivad 24D3 lümfotsüüdid
- Ainult Meth A lüsaat indutseeris neid lümfotsüüte jagunema (A, vasakul)
- 24D3 lümfotsüütidega transplanteeritud hiirtes kasvab küll teine samasugune fibrosarkoom (CMS5, kõige parempoolne pilt) aga mitte Meth A (keskel).
| ID | Age/sex | Tumor | Mutated prot | Aa change | T cell type | % in tumor |
|---|---|---|---|---|---|---|
| 3737* | 45/F | Bile duct | ERBB2IP | E805G | CD4 | 0.009 |
| E805G | CD4 | 0.375 | ||||
| 3812 | 44/M | Bile duct | — | — | — | — |
| 3942 | 46/F | Rectal | NUP98 | A359D | CD8 | 0.67 |
| KARS | D356 | CD8 | 0.020 | |||
| GPD2 | E426K | CD4 | 0.037 | |||
| 3948 | 48/M | Esophageal | PLEC | E1179K | CD4 | NE |
| XPO7 | P274S | CD4 | NE | |||
| AKAP2 | Q418K | CD4 | NE | |||
| 3971 | 49/M | Colon | CASP8 | F67V | CD8 | 1.25 |
| 3978 | 46/F | Bile duct | ITGB4 | S1002I | CD4 | NE |
| 3995 | 50/M | Colon | TUBGCP2 | P293L | CD8 | 0.023 |
| RNF213 | N1702S | CD8 | 0.60 | |||
| KRAS | G12D | CD8 | 0.055 | |||
| 4007 | 52/M | Colon | SKIV2L | R653H | CD8 | 0.090 |
| R653H | CD8 | 0.014 | ||||
| H3F3B | A48T | CD8 | 1.19 | |||
| 4032 | 46/M | Colon | API5 | R243Q | CD8 | 0.083 |
| R243Q | CD8 | 0.059 | ||||
| RNF10 | E572K | CD8 | 0.030 | |||
| PHLPP1 | G566E | CD8 | 0.081 | |||
| 4069 | 57/M | Pancreatic | ZFYVE27 | R6H | CD8 | 0.088 |
---&twocol
***=right
- T lümfotsüüdid
- B lümfotsüüdid
- NK ja NKT rakud
- makrofaagid
- müeloidset päritolu suppressor-rakud
- dendriitrakud
- neutrofiilid
***=left
Pilt www.nature.com---&twocol
NKG2D on aktivatsiooniretseptoriks NK rakkudel -- aktiveerivad killer immunoglobulin-like receptor (KIR) molekulid (NKR-P1, CD94/NKG2(A/B))
***=left
***=right
- NKG2D ekspr. vastusena stressile või DNA kahjustustele, samuti konstitutiivselt vähirakkudel.
- NKG2D ligandid on MICA/B ja RAE valgud
- MICA seostumine NKG2D-le aktiveerib NK rakud
- RAE üleekspressioon hiires muudab need loomad vastuvõtlikumaks kartsinogeneesile.
- Inimese kartsinoomid ja melanoomid üleekspresseerivad lahustuvat MICA ligandi (tekib proteolüütilise lõikamise teel, shedding)
- Inhibeeriv KIR blokeerib MHC-I molekuliga interakteerudes NK rakkude vastuse.
- Rakud millel puuduvad MHC-I molekulid vallandavad NK-vastuse ja tapetakse.
- Osadel kasvajatüüpidel on MHC-I puudumine seotud parema vastusega.
- Vähirakud suruvad adaptiivse immuunvastuse alla ka selleläbi, et reguleerivad ülesse PD-1 ligandi (PD-L1).
- PD-1L on vähirakkudel konstitutiivselt ekspresseeritud.
- PD-L1 seostumine antigeen-spetsiifilistele CD8+ T rakkudel olevale PD-1 retseptorile surub alla nende T rakkude effektor funktsioonid (rakkude tapmine).
- Sarnaselt immuunsupressiivselt toimib ka vähirakkudel jt. keharakkudel ekspresseeritav CTLA-4
--- .segue .dark .nobackground
Andmed: Long-Term Trends in Cancer Mortality in the United States, 1930 –1998. Wingo et al., 2003.
- Suremus osadesse kasvajatüüpidesse on vähenenud. Tingituna näiteks mao- ja maksakasvajate puhul paremast toiduohutusest (H. pylori) ja emakakaela (ja soole-) kasvajate puhul sõeltestimistest.
- Mitmed põhilised kasvajatüübid on jäänud resistentseks enamuse kasutatavate ravimeetodite suhtes.
- Enamus laialt kasutatavatest vähiravimitest on kasutusele võetud juba enne 1970-ndaid aastaid, mil puudus arusaam vähi molekulaarsetest alustest.
Pilt: Cancer Research and the $90 Billion Metaphor. Eliot Marshall, 2011.
Pilt: [PSA screening has also significantly impacted prostate cancer mortality](http://www.forbes.com/sites/benjamindavies/2015/11/15/the-governments-war-against-mens-health-its-about-to-get-worse/), the true measure of a successful screening test. In fact, prostate cancer has enjoyed the largest percent decline in mortality of any carcinoma in the past ten years!
Pilt: [PSA screening has also significantly impacted prostate cancer mortality](http://www.forbes.com/sites/benjamindavies/2015/11/15/the-governments-war-against-mens-health-its-about-to-get-worse/), the true measure of a successful screening test. In fact, prostate cancer has enjoyed the largest percent decline in mortality of any carcinoma in the past ten years!
---&twocol
- Low Risk - ~10% chance of recurrence = no statistical benefit from chemotherapy
- High Risk - ~29% chance of recurrence = statistical benefit from chemotherapy
---&twocol
***=right
- DLBCL subgroups arise from different stages of normal B cell differentiation,
- utilize distinct oncogenic mechanisms, and differ in their ability to be cured by chemotherapy.
- ABC DLBCL and PMBL depend upon constitutive activation of the NF-κB pathway for their survival but GCB DLBCL does not,
- NF-κB pathway is a potential therapeutic target for certain DLBCL subgroups.
Molekulaarne profileerimine annab ka infot selle kohta kas vähk on mingile kindlale märklaud ravile tundlik
- mitte-väikserakuline kopsuvähk, EGFR mutatsioonid määravad tundlikkuse türosiin kinaasi inhibiitoritele (iressa)
- GI strooma vähk, KIT ja PDGFRA mutatsioonid määravad tundlikkuse c-KIT ja PDGFR inhibiitoritele (imatinib)
- metastaatiline soolevähk, mutantne KRAS ennustab mitte-tundlikkuse anti-EGFR antikehadele.
- melanoom, BRAF mutatsioonid mutatsioonid määravad tundlikkuse spetsiifilistele inhibiitoritele (vemurafenib)
- rinnavähk, HER2 amplifikatsioon ennustab tundlikkust anti-HER2 teraapiale.
- Enamus mittekirurgilise vähiravi strateegiatest põhineb sellel, et ravi tagajärjel vähirakud lähevad apoptoosi.
- Alternatiiviks on vähirakkude diferentseeruma suunamine nii, et nad muutuksid post-mitootilisteks.
- APL iseloomustab ebanormaalne mitte-küpsete granulotsüütide akumulatsioon ja on seotud retinoolhappe retseptori (RARα) translokatsiooniga (t(15;17)(q22;q12); PML-RAR).
- Algselt fataalne haigus (kirjeldati 1957) on hästi ravitav all-trans-retinoolhappega mis diferentseerib need vähirakud neutrofiilideks.
- all-trans-retinoolhape põhjustab diferentsatsiooni geene represseeriva PML-RAR valgu ubikvitineerimise ja proteasoomse lagundamise.
- Madalmolekulaarsed ühendid omavad peamiselt inhibeerivat toimet valkudele millele nad seostuvad.
- Reeglina, tuumorsuppressorid ja genoomi korrashoiu eest vastutavad valgud ei sobi seega otseseks ravimi märklauaks: nende funktsiooni on vähirakkudes praktiliselt võimatu taastada.
- Onkogeenid ja neile signaalirajas järgnevad geenid on potentsiaalsed ravimimärklauad.
- PRIMA-1 reageerib mutantse p53 tioolrühmadega ja moodustab kovalentse sideme.
- PRIMA-modifitseeritud p53 omandab uuesti tuumorsupressor aktiivsuse põhjustab rakkude apoptoosi.
- Nutlin-2: Metsik tüüpi p53 assotseerub vähis tavaliselt MDM2 üle-ekspressiooniga. Sellistes kasvajates on võimalik blokeerida MDM2 seostumine p53 (Joonisel b).
- PhiKan083: p53 Y220C mutantset valku on ka võimalik reaktiveerida - PhiKan083 seostumine taastab p53 normaalse konformatsiooni (Joonisel c,d).
- 'Onkogeen sõltuvus' (oncogene addiction): vaatamata tumorigeneesi käigus vähirakku akumuleerunud mitmete onkogeensetele mutatsioonidele, on vähirakk sõltuv kindla onkogeense valgu/raja aktivatsioonist.
- Kui see kriitiline onkogeenne rada 'kinni panna' siis vähk kollapseerub:
- BCR-ABL fuusionvalk kroonilises müelotsüütses leukeemias on tundlik imatinib-le,
- HER2 on amplifitseerunud 25-30% rinnavähkides mis muudab need tundlikuks HER2-antikehadele (trastuzumab) ja inhibiitoritele (lapatinib),
- EGFR 10-20% mitte-väikserakulised kopsuvähid sisaldavad aktiveerivaid mutatsioone kinaasses domäänis ja on tundlikud inhibiitoritele gefitinib ja erlotinib-ile,
- BRAF V600E mutatsioon on 70% melanoomides, 40% kilpnäärmevähkides ja 20% mCRC mis muudab need tundlikuks nt. vemurafenib-ile.
| Transgeenne onkogeen | vähi vastus |
|---|---|
| Vähi täielik regressioon peale transgeeni 'välja lülitamist' | |
| H-ras | melanoom kollapseerus |
| K-ras | kopsu adenokartsinoomi regressioon |
| bcr-abl | B-raku leukeemia regressioon |
| myc | T raku lümfoom, AML regressioon |
| fgf-7 | kopsu epiteeli hüperplaasia regressioon |
| SV40 LT | süljenäärme hüperplaasia regresseerus, kui transgeeni ekspresseeriti <4 kuud |
| Vähk jäi alles või relapseerus peale transgeeni 'välja lülitamist' | |
| SV40 LT | süljenäärme hüperplaasia tuli tagasi, kui transgeeni ekspresseeriti >4 kuud |
| neu | rinnanäärme adenokartsinoom relapseerus |
| myc või wnt | rinnanäärme adenokartsinoom jäi alles |
- Tsütotoksilised kemoterapeutikumid,
- toimivad kiirelt jagunevatele rakkudele (nt. CHOP kombo: Cyclophosphamide, Doxorubicin, Vincristine (Oncovin), Prednisolone).
- Hormoonravimid,
- blokeerivad hormoon-sõltuvate vähirakkude jagunemist ja põhjustavad vähirakkude surma (Lutron, Zytiga),
- Märklaud-ravimid,
- inhibeerivad spetsiifilisi onkovalke, millest vähirakud on sõltuvad (oncogene dependence).
- Immuunravi,
- immuun kontrollpunkt inhibiitorid immune checkpoint inhibitors (ipilimumab:a-CTLA4; pembolizumab: a-PD-L1) (- modifitseeritud T rakud)
-
Märklaud teraapias kasutatavad ravimid jagunevad kaheks peamiseks rühmaks
- madalmolekulaarsed inhibiitorid
- monoklonaalsed antikehad (rituximab,bevacizumab,trastuzumab,etc)
-
Madalmolekulaarsed inhibiitorid jagunevad omakorda mitmeks rühmaks, millest osad on:
- türosiin kinaasi inhibiitorid (imatinib mesylate,gefitinib,sorafenib, sunitinib,etc),
- seriin/treoniin kinaasi inhibiitorid (temsirolimus, everolimus,vemurafenib,etc),
- proteasoomi inhibiitorid (bortezomib).
-
Näiteid märklaud-ravimitest
--- &twocol
***=left
- Valku loetakse sobivaks ravimi märklauaks kui ta omab identifitseeritavat ensümaatilist aktiivsust ja defineeritud katalüütiline sait (catalytic cleft).
- Katalüütilisse lõhesse on võimalik seostada suhteliselt madalmolekulaarne (<1000Da) ühend.
- Mitmed mittekovalentsed sidemed mis sellise madalmolekulaarse ühendi seostumisel moodustuvad, võimaldavad saavutada ravimi kõrge spetsiifilisuse ja aviidsuse (~mitmete kontaktide afiinsuste summa)
***=right
Pilt: BCR-ABL kompleksis imatinib-iga.- Valke millel selge katalüütiline sait puudub peetakse üldiselt ravimimärklauaks sobimatuks, nt. transkriptsioonifaktorid. Onkovalgud MYC ja FOS klassifitseeruvad selliste valkuda hulka. Hormoonretseptorid on siin erand, sest neil on spetsiifiline hormooni siduv domään (tamoksifeen blokeerib östrogeeniretseptori)
- Teisalt ei garanteeri katalüütilise domääni olemasolu, et mingi valgu vastu on mõtet ravimit disainima hakata. Näiteks,
- RAS GTPaasne domään, mida pole mõtet inhibeerida, sest see omab juba isegi madalat RAS-i inhibeerivat toimet.
- türosiin fosfataasid, mis toimivad signaaliraja negatiivses tagasisides.
- Nutlin-2: blokeerib MDM2 seostumise metsik tüüpi p53.
-
ICG-001 blokeerib
$\beta$ -kateniini/CBP (cyclic AMP response-element binding protein binding protein) vahelise interaktsiooni.- CBP on Wnt/$\beta$-kateniini signaaliraja transkriptsiooni koaktivaator, mis koos
$\beta$ -kateniiniga aktiveerib mitmete oluliste anti-apoptootiliste geenide (survivin, IAP) ja ka tsükliin D1 ekspressiooni.
- CBP on Wnt/$\beta$-kateniini signaaliraja transkriptsiooni koaktivaator, mis koos
---&twocol
***=right
***=left
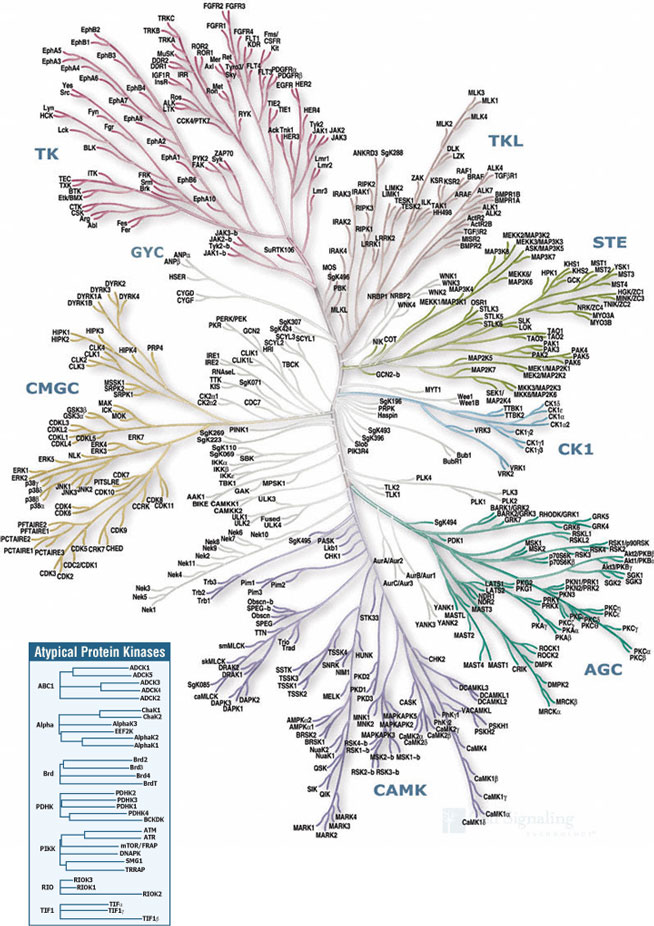
- Inimesel on genoomis 518 kinaasi geeni.
- ~395 kinaasi inhibiitorit ~110 erineva kinaasi vastu on kliinilises arenduses de Castro, 2012.
- Türosiin kinaase on 90 ja seriin-treoniin kinaase 318.
- Kinaasne domään on erinevatel kinaasidel väga sarnane.
Erinevate epidermaalse kasvufaktori retseptori (EGFR) türosiin kinaasi inhibiitorite seostumine kinaasse domääni ATP seostumise lõhesse. Moodustuvad mitmed mittekovalentsed sidemed.
(a) Two-dimensional (2D) structure of reversible inhibitor gefitinib and the three-dimensional (3D) structure in complex with EGFR (PDB code 3UG2). (b) 2D structure of reversible inhibitor erlotinib and the 3D structure of the binding site of EGFR in complex with erlotinib (PDB code 4HJO). (c) 2D structure of the potent irreversible inhibitor afatinib (BIBW-2992) and the 3D structure of the binding site of EGFR in complex with afatinib, showing the covalent interaction with Cys797, highlighted in orange (PDB code 4G5J). PDB, Protein Data Bank. Allikas: de Castro et al., 2013.Pilt: Ringi suurus näitab inhibiitori sidumisafiinsust: suurem on kõrgema afiinsusega. Nature Immunology 10, 356 - 360 (2009).
In vitro ravimiresistentsust vahendavad mutatsioonid BCR-ABL valgus
Pilt: A partially overlapping network of BCR-ABL1 kinase domain mutations confer resistance to certain TKIs. O'Hare et al., 2012.Pilt: de Castro et al., 2013.
---&twocol
***=left
- Faas 1 uuringud viiakse läbi tervetel vabatahtlikel (20-80) ja tehakse kindlaks ravimi ohutu doosi piirkond, uuritakse farmakokineetikat ja identifitseeritakse kõrvalmõjud.
- Faas 2 uuritakse 100-300 inimesel kas ravim on efektiivne võrreldes platseebo/standard raviga ja kõrvalmõjusid. Faasis 2a selgitatakse erinevate dooside toime. Faas 2b selgitab kas ravi(m) on efektiivne. Enamus ravimeid praagitakse välja 2. faasis.
- Faas 3 suured multikeskus (1000-3000) uuringud kinnitavad kliinilise efektiivsuse.
***=right
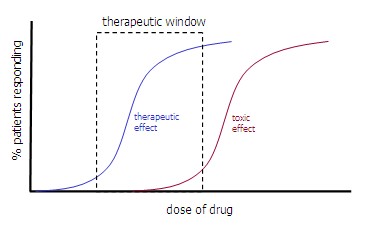
- Terapeutiline aken: ravimi doos mis asetseb efektiivsuse ja toksilisuse vahel.
- The therapeutic window is from 10% of therapeutic effect to 10% of the toxic effect
- Erlotinibi kasutamisega võib patsentidel tekkida nahale aknesarnane lööve.
- Samas assotseerub sellise lööbe teke oluliselt parema ravitulemusega (mitte-väikserakuline kopsuvähk), olles nõnda ka farmakodünaamiliseks markeriks.
| Bränd | näidustus | märklaud | tüüp | müük | firma |
|---|---|---|---|---|---|
| Rituxan | mitte-Hodgkini lümfoom, CLL | CD20 | antikeha | $7.78B | Roche |
| Avastin | kolorektaal-, kopsu-, munasarja- ja ajuvähk | VEGF | antikeha | $6.75B | Roche |
| Herceptin | rinna-, mao- ja söögitoru vähk | HER2/neu | antikeha | $6.56B | Roche |
| Gleevec | leukeemia, GI vähk | BCR-ABL | väike kinaasi inhibiitor | $4.69B | Novartis |
| Alimta | kopsuvähk | puriini ja pürimidiini süntees | kemoterapeutikum | $2.7B | Eli Lilly |
| Velcade | multi müeloom | valkude lagundamine | proteasoomi inhibiitor | $2.6B | Takeda, J&J |
| Erbitux | käärsoole ja pea-kaela vähk | EGFR | antikeha | $1.87B | Merck, BMS |
| Lupron | eesnäärme ja munasarja vähk | gonatotropiin | hormoonravim | $1.73B | AbbVie, Sanofi |
| Zytiga | eesnäärme vähk | androgeen | hormoonravim | $1.7B | J&J |
| Revlimid | multi müeloom, mantelrakk lümfoom | ? | kemoterapeutikum | $1.09B | Celgene |
--- .segue .dark .nobackground
--- &twocol
***=left
- Sissejuhatav loeng
- Vähitüübid
- Onkoviirused
- Onkogeenid
- Retseptorid
- Signaalirajad
- Tuumorsupressorgeenid
- Rakutsüklikontroll
***=right